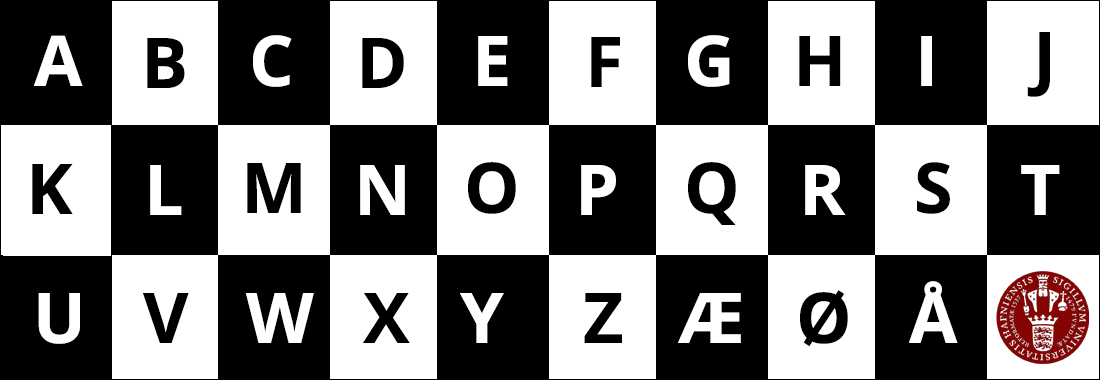Bohrs atommodel
 Grundbeskrivelse
Grundbeskrivelse
Ordet atom stammer fra det græske ord Atomos, der betyder udelelig. Ernest Rutherford, der var født i New Zealand, opstillede en model for hydrogenatomet, hvor kernen var omkredset af elektroner ligesom planeterne omkring Solen. Datidens fysiske love forudsagde, at elektronerne ikke ville blive i deres baner, men bevæge sig mod atomkernen med større og større fart og samtidig udsende lys af meget forskellige farver. Det er ikke det, man ser i lysende hydrogen – hydrogen udsender kun få forskellige farver lys, et liniespektrum.

Niels Bohr og hans model for banerne i hydrogenatomet. (Mette Høst).
En løsning på dette problem var, at Niels Bohr i 1913 opstillede en ny model for hydrogenatomet:
- Atomet kan kun eksistere i nogle ganske bestemte stationære tilstande - eller med andre ord, at elektronerne holder deres stabile baner og ikke nærmer sig atomkernen.
- Atomet kan hoppe fra én tilstand til en anden, men ikke eksistere 'mellem' to tilstande. Når det sker udsender eller modtager atomet energi svarende til energiforskellen mellem de to stationære tilstande.
Bohrs model kunne både forklare hydrogens spektrum, Rutherfords påvisning af atomkernen og andre problemer med modstrid mellem den klassiske fysik og nyere eksperimenter.
 Uddybende beskrivelse
Uddybende beskrivelse
I slutningen af 1800-tallet og begyndelsen af 1900-tallet viste flere og flere eksperimenter, at et atom ikke var udeleligt, men bestod af en række mindre partikler. Elektronen blev opdaget i 1897 af Thomson og i 1911 påviste Rutherford atomets positive, men lille kerne. Ifølge klassisk fysik kan der ikke eksistere stabile atomer, der er opbygget af elektroner i baner om en kerne. Elektronerne vil øjeblikkeligt bevæge sig i en spiralformet bane ind mod atomkernen med større og større fart og derved udsende et kontinuert elektromagnetisk spektrum. Dette var i direkte modstrid med, at hydrogen og andre luftarter udsender et linjespektrum og ikke mindst med, at atomerne jo tydeligvis er stabile over længere tid.
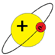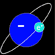
Udsendelse af en foton når atomet går fra en tilstand til en anden med lavere energi (Ploufandsplash, Wikimwdia Commons).
I 1913 opstillede Niels Bohr (1885-1962) en ny atommodel, specielt inspireret af hydrogenspektret. Atommodellen var formuleret som to postulater:
- Atomet kan kun eksistere i nogle ganske bestemte stationære tilstande. I hver af disse tilstande har atomet en bestemt energi.
- Ændringen fra en tilstand med energi E2 til en med lavere energi E1 kan ske ved, at atomet udsender en foton med en energi givet ved: \[ h \cdot f = E_2 - E_1 \] hvor f er fotonens frekvens og h er Plancks konstant. Omvendt kan atomet tilføres den samme energi ved at absorbere en tilsvarende foton.
Lys udsendes i små energiportioner: fotoner som også kaldes kvanter. Jo mindre energispringet er, desto mindre er fotonens frekvens. Omvendt giver store energispring fotonen en kortere bølgelængde og en større frekvens. Bohrs postulater kunne på enestående måde forklare hydrogens liniespektrum og dermed binde den klassiske og den moderne fysik sammen.

Niels Bohr Institutet på Blegdamsvej i København. (Ola Jakup Joensen).
Bohrs atommodel gav anledning til udviklingen af kvantemekanikken og på Institut for Teoretisk Fysik skabte Niels Bohr og hans medarbejderstab af internationalt førende forskere en lang række videnskabelige landvindinger. Efter Bohrs død i 1962 blev instituttet opkaldt efter ham og har siden heddet Niels Bohr Institutet. Det er den dag i dag et vigtigt center for partikelfysik, astronomi, iskerneforskning mm.
Erland Andersen og Christian Petresch
Vælg en kategori