Isotop
 Grundbeskrivelse
Grundbeskrivelse
Atomer, der tilhører det samme grundstof, har altid det samme antal protoner. Antallet af neutroner i atomkernen kan derimod godt variere. Atomer med samme antal protoner og et forskelligt antal neutroner kalder man isotoper, og de kan enten være tungere eller lettere end det 'normale' grundstof. Som regel er det den hyppigst forekommende isotop, der definerer, hvad der er det 'normale'.
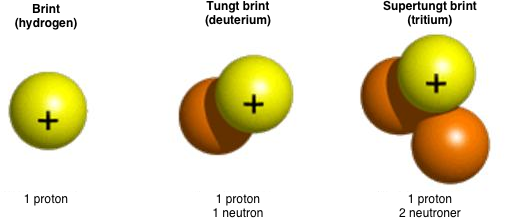
Isotoper af brint (hydrogen).
Hvis isotopen har færre neutroner end den hyppigste grundstofisotop bliver det en let isotop, og hvis der er flere neutroner end det oprindelige grundstof, bliver det en tung isotop. F.eks. har et normalt brintatom (\(\ce{^1_1H}\)) én proton i kernen og én elektron i en bane omkring. Tung brint (\(\ce{^2_1H}\) eller\(\ce{^2_1D}\)), der er en sjælden brint-isotop, har én ekstra neutron i kernen og er derfor tungere. Tritium (\(\ce{^3_1H}\) eller\(\ce{^3_1T}\)) har to neutroner og er radioaktivt med en halveringstid på lidt over 12 år. Den findes ikke i naturen.
Alle isotoper af et grundstof har samme kemiske egenskaber. Men de kan være radioaktive og ustabile, hvis der er en stor ubalance mellem antallet af protoner og neutroner i atomkernen.
To neutroner slutter sig til kernen i et almindeligt oxygenatom, \(^{16}_8\)O og danner en tungere oxygenisotop, \(^{18}_8\)O .
Oxygen (ilt) har atomnummer 8, og i den mest almindelige form har oxygen 8 protoner og 8 neutroner i kernen, dvs. 16 atomkernepartikler i alt, kaldet oxygen-16 (\(^{16}_8O\)). Oxygen findes også som en naturlig isotop med 8 protoner og 10 neutroner, oxygen-18 (\(^{18}_8O\)).
 Uddybende Beskrivelse
Uddybende Beskrivelse
Et grundstofs kemiske egenskaber defineres af, hvor mange elektroner der er omkring atomkernen. Atomer af et givent grundstof har derfor altid det samme antal protoner i kernen, da det er protonerne, der fastholder elektronerne om kernen. Antallet af neutroner i kernen kan derimod godt variere. Atomer af samme grundstof, der indeholder forskellige mængder neutroner, siges at være forskellige isotoper af det samme grundstof, og ordet betyder da også 'på det samme sted' (i det periodiske system).
I naturen findes de enkelte grundstoffer typisk i enkelte fremherskende isotoper. For eksempel findes hydrogen (brint) i to stabile isotoper i naturen. Disse er den sædvanlige atomkerne bestående blot af en proton, og den såkaldte deuterium isotop: \(\ce{^2_1H}\), der indeholder en ekstra neutron. Deuterium er dog overordenligt sjældent, og findes her på Jorden kun ca. i forholdet 1:6400 i forhold til normal hydrogen. Vand, der indeholder deuterium, kaldes 'tungt vand', og har et kogepunkt, der er en grad højere end normalt vand. Dette skyldes det ene hydrogenatoms lidt højere masse, og det er et eksempel på, at selvom de kemiske egenskaber er de samme for alle isotoper af det samme grundstof, så kan de fysiske egenskaber godt være forskellige.
Hvis isotopen har færre neutroner end den hyppigste grundstofisotop bliver det en let isotop, og hvis der er flere neutroner end det oprindelige grundstof, bliver det en tung isotop.
F.eks. har et normalt brintatom (\(\ce{^1_1H}\)) én proton i kernen og én elektron i en bane omkring. Tung brint (\(\ce{^2_1H}\)), der er en sjælden brint-isotop, har én ekstra neutron i kernen og er derfor tungere.
Oxygen (ilt) har atomnummer 8, og i den mest almindelige form har oxygen 8 protoner og 8 neutroner i kernen, dvs. 16 atomkernepartikler i alt, kaldet oxygen-16 (\(\ce{^{16}_8O}\)). Oxygen findes også som en naturlig isotop med 8 protoner og 10 neutroner, oxygen-18 (\(\ce{^{18}_8O}\)).
For alle grundstoffer, der har en stabil isotop, gælder det, at når en isotop afviger for meget fra den stabile isotop, vil den være radioaktiv. For mange tunge grundstoffer som f.eks. uran gælder det, at der ikke findes nogen stabile isotoper af stoffet overhovedet. Tunge isotoper med mange neutroner vil henfalde til grundstoffer på højere pladser i det periodiske system igennem beta-minus-henfald, hvor en neutron henfalder til en proton under udsendelse af en elektron og en anti-elektron-neutrino. Et eksempel er den meget tunge brintisotop, tritium, \(\ce{^3_1H}\), der henfalder til \(\ce{^3_2He}\) (”helium 3”). Der er flere eller færre isotoper af forskellige stoffer, Tin (Sn) har 10 stabile isotoper, 22 stoffer har kun en stabil isotop f.eks guld.
Lette isotoper, derimod, hvor antallet af neutroner er lavt, vil henfalde til lavere pladser i det periodiske system ved et beta-plus-henfald, hvor en proton bliver til en neutron under udsendelse af en positron og en elektron-neutrino.
I stjerners indre er grundstofferne i konstant forandring. Atomkerner smelter sammen (kernefusion), og isotoper ændres til andre isotoper igennem neutron-indfangning. Netop neutronindfangning er den eneste måde at danne grundstoffer tungere end jern på. En atomkerne indfanger løse neutroner, der svæver rundt i stjernens indre. Når den har indfanget for mange neutroner til at kunne være stabil, henfalder nogle af dem til protoner, hvorefter processen gentager sig.
Rasmus Mackeprang
Vælg en kategori





