Atommodel
 Grundbeskrivelse
Grundbeskrivelse
I den simpleste, meget forenklede atommodel kredser elektronerne omkring atomkernen i baner, der er ordnet i skaller med forskellig afstand til kernen.
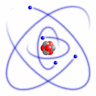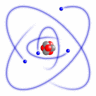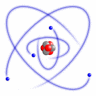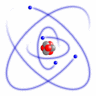
Simpel atommodel (RacoonyRE, Scientific Linux Logo, Wikimedia Commons)
Der kan ikke være lige mange elektroner i hver skal. I den inderste skal er der kun plads til to elektroner, mens der kan være op til otte i den næste. Generelt er det maksimale antal elektroner i en skal det dobbelte af kvadratet på skalnummeret, altså 2,8,18,32,..
Atomerne har en tendens til at foretrække at have op til enten to eller otte elektroner i den yderste skal. Grundstof nr. 18, argon, har henholdsvis 2, 8 og 8 elektroner i skal 1,2 og 3. Der er én elektron mere i kalium, grundstof nr. 19. Den havner i skal 4, fordi der ikke kan være over 8 i den yderste skal. Grundstof 20, calcium, har to elektroner i skal 4. I de følgende grundstoffer fyldes skal 3 op til 18, hvorefter skal 4 fyldes op til 8.
 Uddybende beskrivelse
Uddybende beskrivelse
I en mere realistisk atommodel er elektronerne indplaceret i et system af energiniveauer. Der er den sammenhæng mellem de to modeller, at et højere energiniveau svarer til en større afstand til kernen og dermed en 'skal' med større radius.
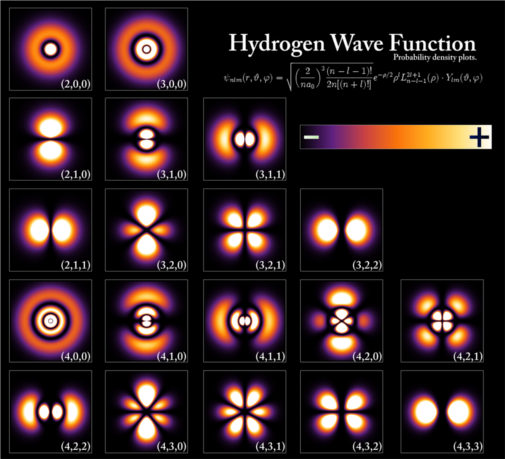
Nogle af brintatomets orbitaler. Kvantetallene n, l, m står i parentes på hver billede. (Kyle Forinash, Wikimedia Commons)
På atomar skala kan tingene ikke beskrives med almindelig klassisk fysik. Elektronernes simple baner omkring kernen er her erstattet af orbitaler - en kvantefysisk måde at beskrive deres tilstand på. En orbital beskrives med en matematisk funktion, bølgefunktion, der angiver, hvordan elektronerne er fordelt udstrakt i rummet omkring atomkernen, snarere end at være i et bestemt punkt, der løber rundt i en bane.
En elektrons tilstand i et atom beskrives ved fire kvantetal. Hovedkvantetallet n svarer til skalnummeret i den simple model. Det kan have værdierne 1,2,3... Elektronens energi afhænger primært af n, men de andre kvantetal spiller også en rolle.
Det azimutale kvantetal l beskriver orbitalernes rumlige form. Det kan være fra 0 op til n-1. En orbital med l=0 er kuglesymmetrisk omkring atomkernen, mens en med l=1 er delt i to dele, der ligger symmetrisk overfor hinanden med kernen i midten.
Det magnetiske kvantetal m beskriver orbitalernes retning i rummet. Det kan have værdier fra -l til +l. Der findes en orbital for hver værdi af m, så der er én orbital med l=0 og tre med l=1.
Det sidste kvantetal er spinkvantetallet s som kan være -½ eller +½.
I et atom kan der ikke være mere end én elektron i en given tilstand. Der kan med andre ord ikke være to elektroner med samme værdi for alle fire kvantetal. Hver orbital kan indeholde to elektroner, en med s=-½ og en med s=+½.
I den inderste skal er n=1. Så vil både l og m være 0 og der er kun én orbital med to elektroner.
I den næste skal er n=2. Her kan l være 0 eller 1. Når l=0, vil m også være 0, men når l=1 kan m være -1, 0 eller +1. Her er der én orbital med l=0 og tre med l=1. I alt bliver der fire orbitaler med otte elektroner når n=2.
Det er her, vi finder forklaringen på, at der kan være to elektroner i den inderste skal, otte i den næste osv.
Energiniveauerne fyldes op nedefra, startende med dem, der har lavest energi. Selv om n betyder mest for energien, har f.eks. en tilstand med n=4 og l=0 lavere energi end en med n=3 og l=2. Derfor fyldes skallerne op i den lidt særprægede rækkefølge.
Michael Quaade
Vælg en kategori





